(16分) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g)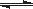 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强 C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是 。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率 ,该温度下,反应的平衡常数K= 。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 |
(16分) (1)N2(2分),∆H= -1591.2 kJ/mol(2分)
(2)ACD(2分) (3)BD(2分)
(4)温度太低,反应速率太低;该反应是放热反应,温度太高,不利于反应向右进行。(2分)
(5)3.70×10-2mol·L-1·min-1 (3分) 81.0 mol4·L-4(3分)
(1)反应中氮元素的化合价从0价降低到-3价,得到电子,所以氮气是氧化剂。2mol氮气得到12mol电子,所以△H=-132.6kJ/mol×12=-1591.2 kJ/mol。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以A正确。速率之比是相应的化学计量数之比,因此B中的关系始终是成立,不正确。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变红的,所以D不正确。答案选ACD。
(3)考查外界条件对反应速率的影响。正反应是放热的、调节增大的可逆反应,升高温度平衡向逆反应方向移动,降低压强,平衡向正反应方向移动,A不正确,B正确。二氧化硅是固体,不影响平衡状态,C不正确。增大氮气浓度,平衡向正反应方向移动,D正确,答案选BD。
(4)由于温度太低,反应速率太低;但反应是放热反应,温度太高,又不利于反应向右进行,所以温度控制在1300~1700oC。
(5)0—20 min内N2的浓度减小了4.00mol./L-3.26mol/L=0.74mol/L、所以反应速率是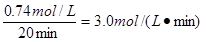 。平衡时氮气和CO的浓度分别是3.00mol/L和(2.70+0.30)mol/L=3.00mol/L,所以平衡常数K=
。平衡时氮气和CO的浓度分别是3.00mol/L和(2.70+0.30)mol/L=3.00mol/L,所以平衡常数K= 。
。