下列说法正确的是
A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: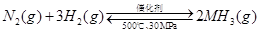 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
B.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(CH3COOH) >c(Na+)>c(H+)>c(OH-)
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl—)。用含a的代数式表示NH3·H2O的电离常数Kb=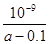
答案:C
A不正确,因为是可逆反应,无法确定转化率,所以不能计算反应热。B不正确,因为醋酸要电离,所以醋酸的浓度不可能大于钠离子的浓度。环己烯(l)与环己烷(l)相比,形成一个双键,能量降低169kJ/mol,苯(l)与环己烷(l)相比,能量降低691kJ/mol,远大于169×3,说明苯环有特殊稳定结构,所以C正确。D中根据电荷守恒可知,溶液显中性,所以OH-的浓度是10-7mol/L,而溶液中c(NH4+)=0.005mol/L,剩余氨水的浓度是 ,所以NH3·H2O的电离常数Kb=
,所以NH3·H2O的电离常数Kb=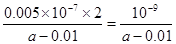 ,D不正确。
,D不正确。
