(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中C02的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)下列关于C02的用途不正确的是 (填序号)。
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分 E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
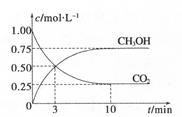
①从反应开始到平衡,氢气的平均反应速率:v(H。)= 。
②该反应的平衡常数为 。
(3)以KHC03溶液为电解质,用电解的方法也可以将CO2还原为甲醇。请写出电解时阴极的离子方程式:
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为 
(10分)
(1)C (2分)
(2)①0.225mol?L-1?min-1(2分)。② 5.33( mol?L-1)-2 (单位不作要求,2分)
(3)CO2+6HCO3-+6e-=CH3OH+6CO32-+H2O(或CO2+5H2O+6e-=CH3OH+6OH -)(2分)
(4)线型碳>石墨烯>金刚石(2分)
(1)燃烧的必要条件是可燃物达到着火点且有氧气,二氧化碳用于灭火主要是采用将可燃物与氧气隔离的办法达到目的
(2)①v(CO2)=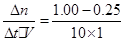 =0.075mol?L-1?min-1,由方程式的系数比可知v(H2)=3v(CO2)=0.225mol?L-1?min-1
=0.075mol?L-1?min-1,由方程式的系数比可知v(H2)=3v(CO2)=0.225mol?L-1?min-1
②依据所给数据,平衡常数K=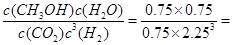 5.33( mol?L-1)-2
5.33( mol?L-1)-2
(3)由化合价的升降可知,CO2中的碳元素与+4价降到CH3OH中碳元素的—2价,得电子,发生了还原反应,故:CO2+6e- CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e-
CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e- CH3OH+6OH -,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH -)
CH3OH+6OH -,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH -)
(4)物质内的键的键能越大,则物质越稳定,由于键能顺序为:碳碳叁键>碳碳双键>碳碳单键,故稳定性由强到弱的顺序为:线型碳>石墨烯>金刚石
