CO2、SO2、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx 浓度的有 (填字母)
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。写出用合成气(CO和H2)生产甲醇的化学方程式 ,已知该反应合成1 mol液态甲醇吸收热量131.9 kJ, 2H2 (g) + CO(g) + 3/2O2g) =CO2 (g) +2H20 (g) △H =-594.1 kJ·mol-1,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式 。
(3)有人设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。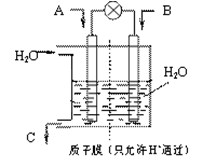
若A为CO2,B为H2,C为CH3OH,则通入CO2的一极为 极;若A为SO2,B为O2,C为H2SO4。则负极的电极反应式为 ;
(4)①在研究氮的氧化物的转化时,某小组查阅到以下数据:17℃、1.01×105 Pa时,
2NO2(g) 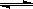 N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
c (N2O4)= (保留两位有效数字);
②改变上述体系的某个条件,达到新的平衡后,测得混合气体中 c (NO2) =" 0.04" mol·L-1, c (N2O4) =" 0.007" mol·L-1,则改变的条件为 ;
(1)acd (2分)
(2)CO+2 H2=CH3OH(2分)
2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1452 kJ·mol-1(3分)
(3)正(1分); SO2+2H 2O-2e— = SO42-+ 4H+ (2分);
(4)①0.012 mol·L-1 (2分)②升高温度(2分)
(1)使用无氟冰箱,减少氟里昂排放,是抑制臭氧层破坏的,b不正确,其余都是正确的,答案选acd。
(2)根据已知的反应物和生成物可知,方程式为CO+2H2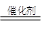 CH3OH。反应①CO(g)+2H2(g)
CH3OH。反应①CO(g)+2H2(g)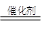 CH3OH(l) △H =+131.9 kJ·mol-1,和反应②2H2 (g) + CO(g) + 3/2O2g) =CO2 (g) +2H20 (g) △H =-594.1 kJ·mol-1,所以根据盖斯定律可知,(②-①)×2即得到 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g),所以反应热△H =(-594.1 kJ·mol-1-131.9 kJ·mol-1)×2=-1452 kJ·mol-1。
CH3OH(l) △H =+131.9 kJ·mol-1,和反应②2H2 (g) + CO(g) + 3/2O2g) =CO2 (g) +2H20 (g) △H =-594.1 kJ·mol-1,所以根据盖斯定律可知,(②-①)×2即得到 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g),所以反应热△H =(-594.1 kJ·mol-1-131.9 kJ·mol-1)×2=-1452 kJ·mol-1。
(3)在反应中碳元素的化合价降低,所以CO2是氧化剂,得到电子,因此CO2在正极通入。SO2失去电子,在负极通入,电极反应式为SO2+2H 2O-2e— = SO42-+ 4H+ 。
(4)①根据平衡常数表达式可知,c (N2O4)=13.3×0.03002=0.012 mol·L-1。
②此时平衡常数是0.007÷0.042=4.375,即平衡常数减小。由于正反应是放热反应,所以改变的条件是升高温度,平衡向逆反应方向移动。
