用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如上图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是 ;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替? (填“能”或“不能”),其原因是 ;
(3)实验时氢氧化钠溶液的浓度要用0.55mol/L的原因是 ;
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),若实验操作均正确,则所求中和热 (填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为: 。
(1)减少热量损失
(2)不能 ①铁会和盐酸反应;②铁导热性好,热量损失较大
(3)为了确保盐酸完全被中和 不相等 相等
(4)NaOH(aq)+HCl(aq)="==" NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
所示装置为:
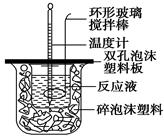
考查中和热的测定,实验的关键是尽量减少热量的损失
(1)在实验中要尽可能的少热量的损失,所以烧杯间填满碎泡沫塑料的作用是减少热量损失的。
(2)铁是金属,属于热的良导体,会使热量损失。另一方面铁能和盐酸反应,所以不能用环形铁质搅拌棒代替环形玻璃搅拌棒。
(3)氢氧化钠过量,能确保盐酸完全被中和,使实验更准确。如果改变酸碱的用量,则反应中放出的热量是不同的,但中和热是不变的。因为中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时所放出的热量。
(4)根据题意可知,热化学方程式为NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H=-57.3kJ/mol
