(17分)I.工业上有一种用CO2来生产甲醇燃料的方法:
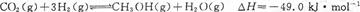
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。图中数据a(1,6)表示:在1 min时H2的物质的量是6 mol。
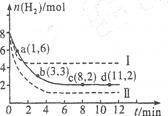
(1)a点正反应速率 (填“大于”“等于”或“小于”)逆反应速率。其化学平衡常数K=
(2)下列时间段平均反应速率最大的是 ,
A.O~1 min
B.1~3 min
C.3~8 min
D.8~11 min(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 ,体积不变再充入3molCO2和4 mol H2,H2O(g)的体积分数 (填“增大”“不变”或“减小”)
Ⅱ.某实验小组欲探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2S04溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、 、 ;
反应的方程式为
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。
(1)电解结束后,在阳极附近的沉淀物中,主要的金属单质为 (填化学式)。
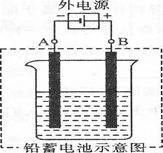
(2) 若按上图所示连接对铅蓄电池进行充电。充电一段时间后。则在A电极上生成 (填化学式)。B电极上的电极反应式为 ;充电完毕。铅蓄电池的正极是 极(填“A”或“B”)。
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而l g水蒸气转化成液态水放热2.445 kJ,则CH4的燃烧热为 (取整数)kJ·mol-。
Ⅰ(1)大于 1/2 (2) A (3) 升高温度 增大压强 增大 Ⅱ淀粉溶液,H2S04溶液 4H+4I-+O2=2I2+2H2O
Ⅲ (1)Ag、Cu (2)Pb PbSO4-2e-+2H2O=PbO2+SO42-+4H+ B (3) 890
Ⅰ(1)a点氢气的物质的量还是在减小的,所以反应是在向正反应方向进行,因此正反应速率大于逆反应速率。平衡时氢气是2mol,则消耗氢气是6mol,所以同时消耗CO2是2mol,生成甲醇和水蒸气是2mol。所以平衡常数等于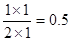 。
。
(2)反应速率越大,反映在曲线上斜率就越大,所以反应速率最大的是O~1 min,即A是正确的。
(3)根据图像可知曲线I对应的反应速率快,平衡时氢气的物质的量大,说明平衡是向逆反应方向移动的,因此改变的条件是升高温度。曲线Ⅱ的反应速率也快,但平衡时氢气的物质的量小,说明向正反应方向移动,因此是增大压强。体积不变再充入3molCO2和4 mol H2,相当于增大压强,平衡向正反应方向移动,所以水蒸气的含量增大。
Ⅱ.由于碘离子易被氧化,碘遇淀粉显蓝色,所以加入的顺序是淀粉溶液、H2S04溶液。方程式为4H+4I-+O2=2I2+2H2O。
Ⅲ.(1)银和铜的金属性弱于镍的,所以阳极中的主要单质是铜和银。
(2)A和电源的负极相连,是阴极,电极产物是铅。B和电源的正极相连,是阳极,电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+。B极产生二氧化铅,所以B是正极。
(3)l g水蒸气转化成液态水放热2.445 kJ,所以1mol水蒸气转化成液态水放热是2.445kJ×18=44.01kJ。生成1mol水蒸气放出的热量是401kJ,所以生成1mol液态水放出的热量是401kJ+44.01kJ=445.01kJ,所以甲烷的燃烧热是445.01kJ×2mol=890kJ/mol。
