低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)。
t1℃时物质浓度(mol/L)的变化

| 时 间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为: 。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为 。
(6) 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g) 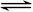 1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
________________________________________________________。
(1)放热 (2分)(2)0.03 (2分)
(3)①平衡 大于(每空1分) ② D A(每空1分)
(4)75% (2分) (5)Y=X(2分)
(6)2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g) △H = -1083.0 kJ·mol-1(3分)
(1)根据表中数据可知,随着温度的升高,平衡常数逐渐减小,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应。
(2)根据图像可知,在0~4 minCO的浓度减少了0.2mol/L-0.08mol/L=0.12mol/L,所以反应速率是0.12mol/L÷4min=0.03mol/(L·min)。
(3)①在3 min~4 min之间,物质的浓度不再发生变化,所以反应达到平衡状态。由于正反应是放热反应,所以升高温度,平衡向逆反应方向移动,因此平衡时C1大于0.08 mol/L。
②增大水蒸气的浓度或降低温度平衡都向正反应方向移动,催化剂不能影响平衡状态,增大氢气浓度平衡向逆反应方向移动,D正确;5min~6min时,CO的浓度降低,水蒸气和氢气的浓度增大,所以平衡向正反应方向移动,因此改变的条件是增大水蒸气的浓度,答案选A。
(4) CO(g) + H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始量(mol) (5-5X) 5X 0 0
转化量(mol) (5-5X)Y (5-5X)Y (5-5X)Y (5-5X)Y
平衡量(mol)(5-5X-5Y+5XY)(5X-5Y+5XY) (5-5X)Y (5-5X)Y
所以有
解得Y=X
所以CO的转化率是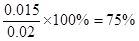
(5) CO(g) + H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始浓度(mol/L) 0.020 0.020 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 0.02-x 0.02-x x x
(6)考查盖斯定律的应用。根据已知反应可知,②×2-①-③×2即得到2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g) ,所以反应热△H=-534.0 kJ·mol-1×2-67.7 kJ·mol-1+26.35 kJ·mol-1×2=-1083.0 kJ·mol-1。
