(10分)Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是天然气的主要成分,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1︰1和l︰2的两种离子化合物。
(1)W在元素周期表中的位置是 周期 族。
(2)工业合成XQ3是放热反应。下列措施中,既能加快反应速率,又能提高原料利用率是 。(填写序号)
A.升高温度
B.加入催化剂
C.将XQ3及时分离出去
D.增大反应体系的压强(3)2.24 L(标准状况)XQ3被200 mL l mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是 。(用离子符号表示)
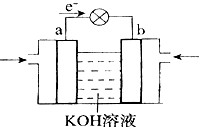
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如右图所示,a极的电极反应是 。
(5)已知:W(s)+Y2(g)=WY2(g);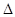 H=-393.5kJ/mol
H=-393.5kJ/mol
WY(g)+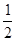 Y2(g)=WY2(g);
Y2(g)=WY2(g);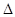 H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。
H=-238.0kJ/mol。则 24g W与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为 。
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式为 。
(1)第二周期、第ⅣA族。 (2)D (3)c(NO3-)>c( H+)>c(NH4+)>c(OH-)
(4)CH4 – 8e- + 10OH- = CO32- + 7H2O (5)CO2、CO 1:8.24
(6)Na3N + 4H2O =" 3NaOH" + NH3.H2O
Q与W组成的化合物是天然气的主要成分,所以Q是H,W是C。机动车排出的大气污染物主要是碳的氧化物和氮的氧化物,因此X是N,Y是O。Y和Z能形成原子个数比为1︰1和l︰2的两种离子化合物,说明Z是钠元素。
(2)氨的合成是放热的、体积减小的可逆反应,升高温度,不利于平衡向正反应方向进行,催化剂不能平衡状态,将XQ3及时分离出去会降低反应速率,正确的答案是D。
(3)0.1molNH3和0.2molHNO3混合后,硝酸过量,溶液中含有的溶质是NH4NO3和HNO3,所以所得溶液中离子浓度从大到小的顺序是c(NO3-)>c( H+)>c(NH4+)>c(OH-)。
(4)根据电子的流动方向可知a是负极,应通入甲烷,所以a极的电极反应是CH4 – 8e- + 10OH- = CO32- + 7H2O。
(5)将所给的热化学方程式合并可得到W(s)+1/2Y2(g)=WY(g);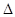 H=-155.5kJ/mol。
H=-155.5kJ/mol。
因此24gC完全燃烧放出的热量是787kJ,不完全燃烧放出的热量是311 kJ,而实际放出362.5
kJ,所以产物是CO和CO2的混合物。根据十字交叉法可计算CO和CO2的物质的量之比是
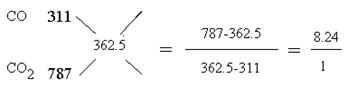
(6)X和Z分别是N和Na,其化合价分别是-3价和+1价,所以其化学式为Na3N,反应的方程式为Na3N + 4H2O =" 3NaOH" + NH3.H2O。
