(本题共8分)
水煤气法制甲醇工艺流程框图如下
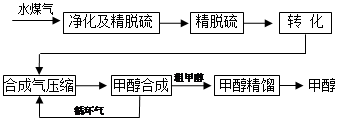
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s)
B.加入H2O(g)
C.升高温度
D.增大压强(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
(1)① ; ②BC(2分)
; ②BC(2分)
(2)Z,催化效率高且活性温度低(或催化活性高速度快,反应温度低产率高)
(3)① > ②0.03 mol·L-1·min-1。
(4)提高原料CO、H2的利用率(或提高产量、产率亦可)。
(1)①平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此平衡常数表达式为 。
。
②碳是固体,增加碳的质量平衡不移动。增大水蒸气的浓度,平衡向正反应方向移动,碳的转化率增大。正反应是吸热反应,升高温度,平衡向正反应方向移动,转化率增大。反应是体积增大的,所以增大压强,平衡向逆反应方向移动,转化率降低,所以正确的答案选BC。
(2)由于反应是放热反应,而Z催化效率高且活性温度低,所以应该选择Z。
(3)①根据表中数据可知,此时 >160,所以正反应速率大于逆反应速率。
>160,所以正反应速率大于逆反应速率。
②设通入的氢气和CO得失y,生成甲醇的浓度是x,则y-2x=0.4mol/L,y-x=0.7mol/L,解得x=0.3mol/L,因此甲醇的反应速率是0.03 mol·L-1·min-1。
(4)生产过程中,合成气要进行循环,其目的是提高原料CO、H2的利用率.
