A、B、C、D、E五种物质是由常见元素组成,A由两种元素组成,且A中两种元素的质量比为7∶8。A和B在高温条件下反应生成C和D,C为无色气体,在标准状况下的密度约为2.86g∙L-1。以A为原料生产E。
⑴写出A的化学式:
⑵A和B的反应中,还原剂与氧化剂的物质的量之比为 ,
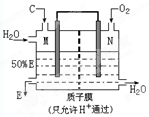
⑶某人设想用右图所示装置利用电化学原理生产E,则N电极是 极;写出M电极的电极反应式: 。
⑷当图中的C与O2被活性炭吸附时,也能发生反应生成F,为研究此反应,将C和O2放入体积为2L的恒容密闭容器中,在500℃时发生反应,反应过程中的能量变化如下图所示,反应物物质的量和时间的变化如下表所示:
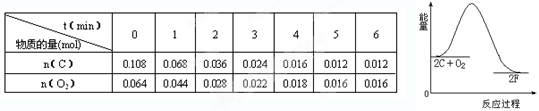
①该反应的ΔH 0反应从起始至2min内的平均反应速率v(C)= ;
500℃时,此反应化学平衡常数K的值为 。
②第6min时,向容器中再充入0.002molO2,同时将反应体系的温度改变为T,反应至10min时重新达到平衡,此时测得c(C)=0.006mol∙L-1,则温度T (填“>”或“<”)500℃。
⑴ FeS2 ⑵ 11∶4, ⑶正极;SO2-2e-+2H2O=SO42-+4H+。
⑷①<; 0.018mol·L-1·min-1; 8000 ②>
(1)在标准状况下的密度约为2.86g∙L-1,则C的相对分子质量是2.86×22.4=64,所以C是SO2。所以根据A的组成可知,A是FeS2。
(2)FeS2在反应中失去3-2+(4+1)×2=11个电子,而氧气只能得到4个电子,所以根据电子得失守恒可知,还原剂与氧化剂的物质的量之比为11∶4。
(3)原电池中负极失去电子,正极得到电子,N极通入氧气,所以N是正极。SO2在M极通入,电极反应式为SO2-2e-+2H2O=SO42-+4H+。
(4)①根据图像可知,反应物的能量高于生成物的能量,所以是放热反应,△H小于0。2min内SO2的变化量是0.108mol-0.036mol=0.072mol,所以其反应速率是0.072mol÷2L÷2min=0.018mol·L-1·min-1。平衡时SO2和氧气的浓度分别是0.006mol/L、0.008mol/L,生成SO3是0.054mol/L-0.006mol/L=0.048mol/L,所以平衡常数为
②增大氧气浓度平衡向正反应方向移动,但最终平衡后SO2浓度不变,说明改变温度应该是升高温度,平衡向逆反应方向移动。
