(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q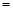 kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L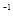 ) ) | 0.44 | 0.6 | 0.6 |
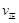 (甲醇)
(甲醇) 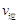 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。 反应开始时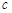 (CH3OH)
(CH3OH)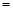 ;
;
该时间内的平均反应速率 (CH3OH)
(CH3OH)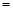 ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
(1).C +H2O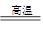 CO +H2 (1分) (2).H2S+Na2CO3 →NaHS + NaHCO3 (1分)
CO +H2 (1分) (2).H2S+Na2CO3 →NaHS + NaHCO3 (1分)
(3).246.4 (2分) a c (2分)
(4).> (1分) 1.64 mol·L-1 (1分) 0.12mol/L·min (1分) 1.86 (1分)
(1)碳在高温下和水蒸气反应,即生成水煤气,反应式为C +H2O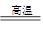 CO +H2 。
CO +H2 。
(2)两种酸式盐分别是NaHS和 NaHCO3,所以方程式为H2S+Na2CO3 →NaHS + NaHCO3。
(3).根据盖斯定律可知,①×2+②+③即得到3H2(g)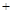 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g)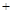 CO2(g)
CO2(g)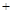 Q,所以Q=90.8 kJ×2+23.5 kJ+41.3 kJ=246.4kJ。由于正反应是体积减小的、放热的可逆反应,所以a正确。催化剂不能改变平衡状态,b不正确,才是降低生成物的浓度,平衡向正反应方向移动,正确。d中平衡虽然向正反应方向移动,但CO的转化率是降低的,不正确。
Q,所以Q=90.8 kJ×2+23.5 kJ+41.3 kJ=246.4kJ。由于正反应是体积减小的、放热的可逆反应,所以a正确。催化剂不能改变平衡状态,b不正确,才是降低生成物的浓度,平衡向正反应方向移动,正确。d中平衡虽然向正反应方向移动,但CO的转化率是降低的,不正确。
(4).根据水利之比是相应的化学计量数之比可知,甲醇的反应速率大于水蒸气的反应速率。平衡时生成水蒸气是0.6mol/L的,则消耗甲醇是1.2mol/L的,所以开始是甲醇的浓度是1.2mol/L+0.44mol/L=1.64mol/L。平衡常数是反应达到化学平衡时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以是