问题
选择题
下列说法正确的是:( )
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3
C.已知:
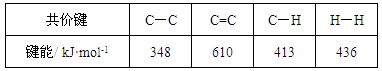
则反应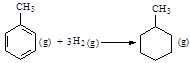 的焓变为ΔH = -384 kJ·mol-1
的焓变为ΔH = -384 kJ·mol-1
D.一定浓度的NaOH溶液,温度升高PH值不变
答案
答案:A
根据电离平衡常数可知,HCN的酸性强于HCO3-的,所以B种反应应该生成碳酸氢钠,不正确。C不正确,因为苯种不存在碳碳单键和碳碳双键。温度升高,水的离子积常数增大,所以pH降低,D不正确。答案选A。
