(13分)由方铅矿(PbS)制备Pb和PbO2的方法如下:
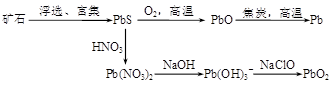
PbO与焦炭煅烧时可能会发生如下反应:
PbO(s)+C(s)=Pb(s)+CO(g) ΔH=+108.5 kJ·mol—1 ①
PbO(s)+CO(g)=Pb(s)+CO2(g) ΔH=-64 kJ·mol—1 ②
(1)已知Pb与O2反应的热化学方程式为:2Pb(s)+O2(g)=2PbO(s) ΔH=-438 kJ·mol—1
则C完全燃烧的热化学方程式为 。
(2)能提高反应②中PbO转化率的措施有 (填字母)。
a.升高温度 b.增大压强 c.加入焦炭 d.加入催化剂
(3)制备过程中会产生SO2、NO、CO等有毒气体,可将它们按一定比例混合在一定条件下反应得到S、N2和CO2。若SO2与NO的体积比为1∶2,该反应的化学方程式为 。
(4)水溶液中铅的存在形态有多种,各形态的浓度分数α随溶液pH变化的关系如下图所示:
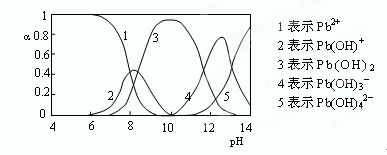
pH=6.5时,Pb2+水解的离子方程式为 ;加入NaClO制备PbO2之前需先用NaOH调节溶液pH至12.5,理由是 。
(1)C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol—1 (2)c
(3)SO2+2NO+4CO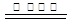 S+N2+4CO2
S+N2+4CO2
(4)Pb2++H2O Pb(OH)++H+ 此时Pb(OH)3-含量最高
Pb(OH)++H+ 此时Pb(OH)3-含量最高
(第(4)题每空2分,其余每空3分,共13分)
(1)根据盖斯定律可知,①+②+③即得到C(s)+O2(g)=CO2(g) ,所以反应热ΔH=+108.5 kJ·mol—1―64 kJ·mol—1―438 kJ·mol—1=-393.5 kJ·mol—1。
(2)正反应是放热反应,升高温度平衡向逆反应方向移动,转化率降低;反应前后体积不变,改变压强平衡不移动;催化剂不能影响平衡状态;加入焦炭,能消耗CO2,降低CO2浓度,平衡向正反应方向移动,转化率增大,答案选c。
(3)根据化合价的变化可知,SO2和CO是还原剂,NO是氧化剂,所以根据电子的得失守恒可知,反应的方程式是SO2+2NO+4CO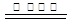 S+N2+4CO2。
S+N2+4CO2。
(4)根据图像可知,pH=6.5时,水解产物是Pb(OH)+,所以水解方程式是Pb2++H2O Pb(OH)++H+;根据图像可知,此时溶液中Pb(OH)3-含量最高,反应易于发生。
Pb(OH)++H+;根据图像可知,此时溶液中Pb(OH)3-含量最高,反应易于发生。
