工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) +2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。
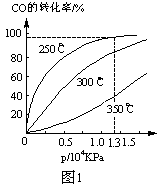
①该反应△H___0(填“>”或“<”)。
②实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
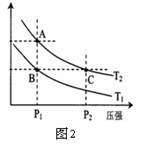
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量。写出该反应的热化学方程式 。
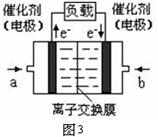
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式 。
(1)c d (2分)
(2)① <(2分) ②在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,故得不偿失。(2分)
(3)<,=,升温(共6分,各2分)
(4)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H="-4Q" kJ/mol(3分)
(5)CH3OH-6e-+8OH- =CO32-+6H2O(3分)
题目分析:(1)a、生成CH3OH的速率与消耗CO的速率都是正反应速率,不能作判断平衡的依据;b、因为气体质量守恒,容器恒容,密度为定值,故密度不变不能作为判断平衡的依据;c、反应前后气体的系数不等,所以混合气体的总物质的量不变说明反应达到平衡;d、反应物或生成物浓度不变,可说明反应达到平衡。
(2)①、温度升高,CO的转化率减小,说明正反应为放热反应,则∆H<0。
②、根据图示可知在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,增大压强,需要增强动力设备和反应装置的抗压能力,生产成本增加,得不偿失。
(3)A、C点温度相同,C点压强大,则反应速率快;温度不变,平衡常数相等;A点H2体积分数大,因为正反应为放热反应,所以A点温度高于B点,由状态B变为状态A需升温。
(4)写出甲醇燃烧的化学方程式并注明状态,因为CH3CH2OH的系数为2,则△H="-4Q" kJ•mol‾1,可得热化学方程式。
(5)因为电解质溶液为KOH溶液,CH3OH在OH‾存在的条件下失去电子生成CO32‾、H2O,配平可得电极方程式:CH3OH-6e-+8OH- =CO32-+6H2O。
