问题
选择题
下列说法不正确的是
A.铅蓄电池在放电过程中,正负极质量均增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> O
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.将浓度为0.1mol·L-1的HF溶液加水不断稀释,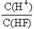 的值始终保持增大
的值始终保持增大
答案
答案:C
题目分析:铅蓄电池在放电过程中,正极反应式是Pb-2e-+SO42-=PbSO4↓,负极反应式PbO2+2e-+4H++ SO42-=+2H2O+ PbSO4,A正确;反应C(s)+CO2(g)=2CO(g)需在高温下才能进行,根据吉布斯自由能G =" H" – TS,可知B正确;Ksp只与温度有关,C错误;HF溶液加水不断稀释,电离平衡常数K=,因为K不变,[F-]不断减小,故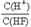 的值始终保持增大,D正确。
的值始终保持增大,D正确。
点评:《化学反应原理》一书是高考的重难点,考生在备考过程中应注意抓住各章节的重点,通过常见的考题,学会灵活分析应用。
