硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI Ⅱ. 2HI H2+I2(g)
H2+I2(g)
Ⅲ. 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。那么,0~2 min内的平均反应速率:υ(HI)= 。
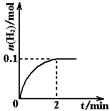
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.压强 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)用足量Zn和一定量的硫酸制取H2,反应时溶液中水的电离
(H2O H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的 。
H++OH-)平衡 移动(填“向左”“向右”或者“不”);若要减小产生H2的速率而又不影响产生H2的总量,应向硫酸中加入下列试剂中的 。
a.Na2CO3溶液 b.K2SO4溶液 c.NaNO3溶液 d.水 e.CuSO4溶液
(4)以H2为燃料制成燃料电池,若:2H2(g)+O2(g)=2H2O(l) ΔH=-572 kJ/mol,
当电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为 。
(1)c (2)0.1 mol/(L·min) ab (3)向右 bd (4)80%
题目分析:(1)H2SO4在常温下,很稳定不易分解,所以a不正确;反应Ⅰ中SO2是还原剂,HI是还原产物,故还原性SO2>HI,则b不正确;将Ⅰ和Ⅱ分别乘以2和Ⅲ相加得:2H2O=2H2+O2,因此c正确,d不正确,大小c。
(2) υ (H2)=0. 1mol/1L/2min=0.05 mol•L-1•min-1,则υ (HI)=2 υ (H2)=0.1 mol•L-1•min-1;若开始时加入HI的量是原来的2倍,则建立的平衡状态和原平衡是等比平衡,即HI、H2、I2的物质的量、平衡浓度都是原来的两倍;各组分的百分含量、体积分数相等,平衡常数相等(因为温度不变);因开始时的浓度增大了,反应速率加快,达平衡时间不可能是原来的两倍,所以答案选ab。
(3)水的电离平衡为H2O H++OH-,硫酸电离出的氢离子对水的电离起抑制作用,当锌消耗了氢离子后,氢离子浓度减小,水的电离平衡向右移动;若加入硝酸钠,溶液相当于是硝酸的溶液,不再生成H2;加入的Na2CO3溶液会和氢离子反应,降低氢离子浓度,反应速率减慢;硫酸钾溶液和水都是相当于是稀释,氢离子浓度较低,反应速率较低,但氢气总量不变;加入CuSO4后,锌与置换出的Cu构成原电池,加快了反应速率,所以答案选bd。
H++OH-,硫酸电离出的氢离子对水的电离起抑制作用,当锌消耗了氢离子后,氢离子浓度减小,水的电离平衡向右移动;若加入硝酸钠,溶液相当于是硝酸的溶液,不再生成H2;加入的Na2CO3溶液会和氢离子反应,降低氢离子浓度,反应速率减慢;硫酸钾溶液和水都是相当于是稀释,氢离子浓度较低,反应速率较低,但氢气总量不变;加入CuSO4后,锌与置换出的Cu构成原电池,加快了反应速率,所以答案选bd。
(4)根据热化学反应方程式可知,生成1mol水时放出热量为572 kJ÷2=286 kJ,所以该电池的能量转化率为228.8 kJ÷286 kJ×100%=80%。
点评:该题是2010年山东理综试题,在能力方面考查了“能够将实际问题分解,通过运用相关知识,采用分析、综合的方法解决简单化学问题的能力”、“能够将分析解决问题的过程和成果用正确的化学术语及文字、图表、模型、图形等表达,并作出解释的能力”,对考生的基础知识和心理素质要求较高。
