多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
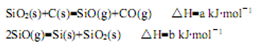
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是 。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

①X是 (填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(选填“>”、“<”、“=”)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
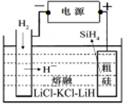
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为 。
(1)①2a+b ② SiO+2NaOH=Na2SiO3+H2↑
(2)①SiHCl3 ②>
(3)Si - 4e- + 4H- = SiH4↑ Si3N4
题目分析:(1)方程式中上式乘2加下式即得;(2)根据氧化还原反应化合价升降确定还原产物为H2, SiO+2NaOH=Na2SiO3+H2↑;(3)随着横坐标数值增大,氢气的含量增大,X转化率增大,所以该物质是SiHCl3;相同比值时,温度越高,SiHCl3转化率越大,故正反应为吸热反应,温度越高K值越大;(3)电解时粗硅溶解结合介质中的H-,故为Si-4e-+ 4H- = SiH4↑;根据质量关系计算物质的量关系确定化学式。
