研究氮及其化合物具有重要意义。请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g) +NO(g) +NO2(g) 2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
2N2(g) +3H2O(g) △H<0,反应的氧化剂是________________。
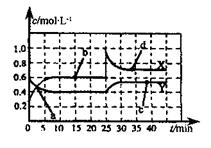
(2)巳知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
N2O4(g) △H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图所示。则图中两条曲线X和Y,表示N2O4浓度变化的是____,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是_________。
(3)25℃时,将NH3溶于水得100 mL0.1 mol • L-1的氨水,测得pH=11,则该条件下,NH3 • H2O的电离平衡常数Kb=_______。
(4)已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;
2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;
C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol。
则反应4CO(g)+2NO2(g)=4CO2 (g)+ N2(g) △H=________。
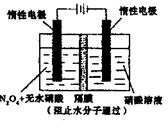
(5)用电化学法可获得N2O5。如图装置中,阳极的电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,则该电解反应的化学方程式为________________。
(每空2分,共14分)(1)NO和NO2 (2)Y;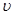 (c)=
(c)=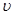 (d)>
(d)>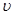 (b);增大NO2的浓度
(b);增大NO2的浓度
(3)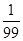 ×10-3mol/L(少单位扣1分) (4)-1200kJ/mol(少单位扣1分,少“-”扣1分)
×10-3mol/L(少单位扣1分) (4)-1200kJ/mol(少单位扣1分,少“-”扣1分)
(5)N2O4+2HNO3 2N2O5+H2↑
2N2O5+H2↑
题目分析:(1)根据反应的方程式可知,氨气中氮元素的化合价从-3价升高到0价,失去3个电子,因此氨气是还原剂。NO和NO2中氮元素的化合价分别从+2价和+4价降低0价,得到2个和4个电子,因此氧化剂是NO和NO2。
(2)由图可知10~25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6=0.4)mol/L=0.2mol/L。即X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;由图可知,10~25min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,因此c和d点的反应速率相等。25min后NO2和N2O4的浓度增大,因此反应速率增大,即b、c、d三点的化学反应速率大小关系是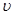 (c)=
(c)=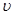 (d)>
(d)>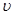 (b);根据图像可知,25min时NO2的浓度瞬间增大,而N2O4的浓度逐渐增大,所以25min时,曲线发生图中变化,可采取的措施是增大NO2的浓度。
(b);根据图像可知,25min时NO2的浓度瞬间增大,而N2O4的浓度逐渐增大,所以25min时,曲线发生图中变化,可采取的措施是增大NO2的浓度。
(3)氨水溶液中测得pH=11,因此溶液中c(OH-)=0.001mol/L,则根据电离方程式NH3·H2O OH-+NH4+可知,溶液中c(NH4+)=0.001mol/L,则溶液中c(NH3·H2O)=0.1mol/L-0.001mol/L,所以该温度下氨水的电离常数Kb=
OH-+NH4+可知,溶液中c(NH4+)=0.001mol/L,则溶液中c(NH3·H2O)=0.1mol/L-0.001mol/L,所以该温度下氨水的电离常数Kb=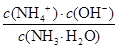 =
=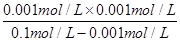 =
=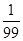 ×10-3mol/L。
×10-3mol/L。
(4)已知反应①:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol;②:2NO(g)+O2(g)=2NO2(g) △H=-112kJ/mol;③:2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;④:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol,依据盖斯定律可知,(④×2-③)×2-①-②即得到反应式4CO(g)+2NO2(g)=4CO2 (g)+ N2(g),所以该反应的反应热△H=(-393.5kJ/mol×2+221kJ/mol)×2-180kJ/mol+112kJ/mol=-1200kJ/mol。
(5)电解池中阳极失去电子,发生氧化反应。阴极得到电子,发生还原反应。则阴极是溶液中的氢离子得到电子生成氢气,阳极是N2O4失去电子生成N2O5,所以总的反应式是N2O4+2HNO3 2N2O5+H2↑。
2N2O5+H2↑。
