天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) 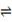 CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH =" +206.2" kJ/mol
CH4(g) + 2H2O(g) 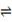 CO2(g) +4H2(g) ΔH = +165.0kJ/mol
CO2(g) +4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
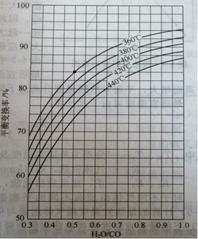
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是 。
② 汽气比相同时,CO平衡变换率与温度的关系是 。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp= 。随温度的降低,该平衡常数 (填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
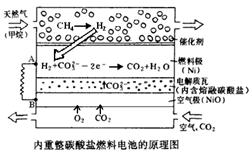
(1)外电路电子流动方向:由 流向 (填字母)。
(2)空气极发生反应的离子方程式是 。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e‑转移,有 g 精铜析出。
(12分)
Ⅰ(1)CO(g)+H2O(g)  CO2(g)+H2(g) ΔH = -41.2 kJ/mol (2分)
CO2(g)+H2(g) ΔH = -41.2 kJ/mol (2分)
(2)①汽气比越大CO平衡变化率越大 (1分)
②温度越高CO平衡变化率越小 (1分)
(3) Kp= 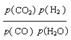 (1分)
(1分)
增大 (1分)
Ⅱ(1)由A流向B (2分)
(2)O2+4e-+2CO2=2CO32- (2分)
(3)19.2 (2分)
题目分析:Ⅰ(1)①CH4(g) + H2O(g) 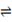 CO(g) + 3H2(g) ΔH1 =" +206.2" kJ/mol
CO(g) + 3H2(g) ΔH1 =" +206.2" kJ/mol
②CH4(g) + 2H2O(g) 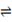 CO2(g) +4H2(g) ΔH2 = +165.0kJ/mol
CO2(g) +4H2(g) ΔH2 = +165.0kJ/mol
加减消元,②―①得ΔH =ΔH2―ΔH1=165.0kJ/mol―206.2 kJ/mol=-41.2 kJ/mol,答案:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH = -41.2 kJ/mol (2分)
CO2(g)+H2(g) ΔH = -41.2 kJ/mol (2分)
(2)①由汽气比与CO平衡变换率的关系图,选取某一温度,随汽气比增大,CO平衡变换率变大,故答案:汽气比越大CO平衡变化率越大 (1分)
②在汽气比与CO平衡变换率的关系图中,将横坐标汽气比固定,作纵坐标的平行线,得:温度越高CO平衡变化率越小 ,答案:温度越高CO平衡变化率越小 (1分)
(3)由方程式CO(g)+H2O(g)  CO2(g)+H2(g)得Kp=
CO2(g)+H2(g)得Kp= 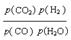 ,答案: Kp=
,答案: Kp= 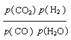 (1分)
(1分)
反应的△H=-41.2 kJ/mol,是放热反应,降低温度,平衡正向移动,平衡常数增大,答案:增大 (1分)
Ⅱ(1)外电路电子由负极移向正极,由A流向B ,答案:由A流向B(2分)
(2)空气中氧气作氧化剂,在碳酸盐体系中,CO2变成CO32―,答案:O2+4e-+2CO2=2CO32- (2分)
(3)由关系式Cu2+ +2e―=Cu得m(Cu)=0.6mol/2×64g·mol-1=19.2g,答案:19.2 (2分)
