研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H 1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) △H 2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
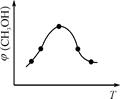
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。

(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比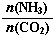 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—28.5 kJ·mol-1(2分)
(2)① (2分) ②<(2分) ③>(2分)
(2分) ②<(2分) ③>(2分)
(3)①2NH3+CO2 CO(NH2)2+H2O(2分) 40%(2分)
CO(NH2)2+H2O(2分) 40%(2分)
②CO2+8e—+8H+=CH4+2H2O(2分)
题目分析:(1)反应①- ②×3可得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=—28.5 kJ·mol-1;(2)②该图像是反应过程图,最高点前是未平衡时的变化,最高点后的是平衡变化,即温度升高平衡逆向进行,反应放热;③由图判断曲线Ⅱ对应的反应反应速率快,温度高,甲醇含量低,K值小;(3)①反应为2NH3+CO2 CO(NH2)2+H2O,设氨气的物质的量为3mol,则二氧化碳的量为1mol,有
CO(NH2)2+H2O,设氨气的物质的量为3mol,则二氧化碳的量为1mol,有
2NH3+CO2 CO(NH2)2+H2O
CO(NH2)2+H2O
始量 3 1 0 0
转化量 1.2 0.6 0.6 0.6
平衡量 1.8 0.4 0.6 0.6
则NH3的平衡转化率为1.2÷3=0.4
②根据信息,在酸性介质中反应为CO2+8e—+8H+=CH4+2H2O。
