问题
多选题
| 电路中C是平行板电容器,S先触1后又扳到2,若这时将平行板的板间距拉大一点,下列说法正确的是( ) A.平行板电容器两板的电势差不变 B.平行扳电容器带电量不变 C.平行板电容器两板的电势差增大 D.平行板电容器两板间的电场强度不变 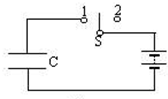 |
答案
BCD
| 电路中C是平行板电容器,S先触1后又扳到2,若这时将平行板的板间距拉大一点,下列说法正确的是( ) A.平行板电容器两板的电势差不变 B.平行扳电容器带电量不变 C.平行板电容器两板的电势差增大 D.平行板电容器两板间的电场强度不变  |
BCD