锌锰干电池是最早使用的化学电池,其基本构造如图所示.
(1)锌锰干电池的负极是______,电路中每通过0.2mole-,负极质量减少______g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了下列实验.
电池内黑色糊状物粉末
无色溶液
溶解过滤
黑色残渣
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ ______ | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是 ______ |
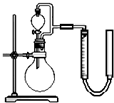
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
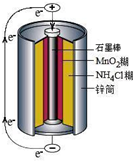
(1)锌锰干电池的负极是锌,正极为石墨棒,电解质溶液为二氧化锰和氯化铵,负极发生氧化反应,
电极反应式为Zn-2e-=Zn2+,根据电极反应式可知,电路中每通过0.2mole-,消耗0.1molZn,质量为0.1mol×65g/mol=6.5g,正极发生还原反应,工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,应为NH3,电极反应式为2NH4++2e-=2NH3↑+H2↑,
故答案为:Zn;6.5;2NH4++2e-=2NH3↑+H2↑;
(2)无色溶液中存在Zn2+、NH4+离子,加入NaOH发生反应Zn2++2OH-=Zn(OH)2↓,有白色沉淀产生,Zn(OH)2是两性氢氧化物,继续反应,沉淀溶解,反应为Zn(OH)2+2OH-=ZnO22-+H2O,然后发生NH4++OH-
NH3↑+H2O,产生有刺激性气味的气体,故答案为:白色沉淀消失,产生有刺激性气味的气体;NH4++OH- △ .
NH3↑+H2O; △ .
(3)实验一反应的方程式为2H2O2
2H2O+O2↑,生成56ml氧气,即 MnO2 .
=0.0025mol,则消耗的H2O2物质的量为0.005mol,0.056L 22.4L/mol
实验二反应的方程式为H2O2+2H++MnO2=Mn2++2H2O+O2↑,生成112ml氧气,即
=0.005mol,则消耗的H2O2物质的量为0.005mol,故答案为:1:1;H2O2+2H++MnO2=Mn2++2H2O+O2↑.0.112L 22.4L/mol
