问题
问答题
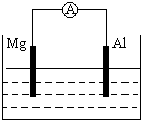
如图所示装置
(1)若烧杯中为稀H2SO4,两极反应式为:
正极______
负极______
总反应方程式______
(2)若烧杯中为NaOH溶液,总反应方程式为:______.
答案
(1)Mg、Al都和稀硫酸反应,但Mg失电子的能力大于 Al,所以Mg作负极,Al作正极,负极上Mg失电子变成离子进入溶液,所以电极反应式为:Mg-2e-=Mg2+.正极上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑;正负极上的电极反应式相加即得电池反应式,所以电池反应式为Mg+H2SO4=MgSO4+H2↑.
故答案为:正极2H++2e-=H2↑
负极Mg-2e-=Mg2+
总Mg+H2SO4=MgSO4+H2↑
(2)Al和氢氧化钠溶液反应,Mg和氢氧化钠溶液不反应,Al失电子和氢氧根离子生成偏铝酸根离子和水,即Al-3e-+4 OH-=AlO2-+2 H2O,所以 Al作负极发生氧化反应;
Mg作正极,正极上水得电子生成氢气和氢氧根离子,发生还原反应,正极上的电极反应式为
6H2O+6e-=6OH-+3H2↑
所以电池反应式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
