Zn-MnO2干电池应用广泛,其示意图如下,电解质溶液是ZnCl2-NH4Cl混合溶液.
(1)该电池的负极材料是______.电池工作时,电子流向______(填“正极”或“负极”).
(2)如果该电池的工作原理为:Zn+2NH4Cl=ZnCl2+2NH3+H2,其正极反应式为:______
(3)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀.其主要原因是______.欲除去Cu2+,最好选用下列试剂中的______(填代号).
a.NaOHb.Zn c.Fed.NH3•H2O
(4)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液.阴极的电极反应式是:______;若电解电路中通过2mol电子,MnO2的理论产量为______.
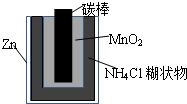
(1)负极上是失电子的,则Zn失电子为负极,电子由负极流向正极,
故答案为:Zn(或锌);正极;
(2)正极上是阳离子的电子发生还原反应的过程,该反应为2NH4++2e-=2NH3+H2,
故答案为:2NH4++2e-=2NH3+H2;
(3)电化学腐蚀较化学腐蚀更快,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.题目中a和d选项不能除去杂质离子,c项会引入新杂质,所以应选Zn将Cu2+置换为单质而除去,
故答案为:锌置换出铜,Zn+Cu2+=Cu+Zn2+,在溶液中,构成铜锌原电池,加快化学反应速率;b;
(4)阴极上得电子,发生还原反应,H+得电子生成氢气,因为MnSO4~MnO2~2e-,通过2mol电子产生1molMnO2,其质量为87g,
故答案为:2H++2e-→H2;87g.
