下图两个装置中,液体体积均为400 mL,开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间后,测得两池均有0.02 mol电子转移,若忽略溶液体积的变化,下列叙述正确的是
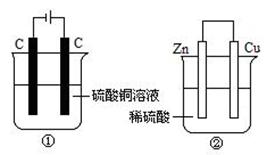
A.②装置中硫酸根离子移向铜极
B.①中阴极质量增加,②中正极质量减小
C.产生气体的物质的量: ①=②
D.溶液的pH变化:①减小,②增大
A项,②是原电池,锌作负极失电子生成Zn2+,锌极显正电性,带负电的硫酸根离子会移此极;B项,①中阴极反应式:Cu2++2e-=Cu,显然增加,②中正极反应式2H++2e-=H2↑,显然该极质量不变,故B项错误;C项,据①中电极反应式:阴极:Cu2++ 2e- =" "
0.2mol 0.4 mol
Cu,0.02mol小于0.4mol,即Cu2+没有放电完,
阳极:4OH-- 4e-= 2H2O + O2↑, 据②中电极反应式:正极:2H+ + 2e-= H2↑,故两
0.02 mol 0.005 mol 0.02mol 0.01mol
装置中产生气体的物质的量不相等;D项,据①中总反应式:2Cu2++2H2O 2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
2Cu+O2↑+4H+,可知溶液的pH减少,据②中总反应式:Zn +2H+ = Zn2++ H2↑,可知溶液的pH增大。
答案:D
