问题
填空题
分别用A、B、C、D四块金属片做如图所示实验,实验数据如下:
| 金属片 | 电子流动方向 | 电压表读数 |
| A | Cu←A | +0.67 |
| B | Cu→B | -0.71 |
| C | Cu←C | +1.35 |
| D | Cu←D | +0.30 |
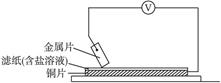
已知:构成两电极的金属活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)_________金属可能是最强的还原剂。
(2)_________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是_________(填字母)。金属对应的原电池的电极反应为:负极: _________,正极: _________。
答案
(1)C (2)B (3)B
2Cu+4OH--4e-====2Cu(OH)2
O2+2H2O+4e-====4OH-
(1)两极金属活动性相差越大,电压表读数越大,表中四个原电池,电压数值绝对值C最大,且C中电子流动方向由C→Cu,故C的还原性最强。
(2)B中电流方向应Cu←B,构成原电池后,Cu作负极,故B不会与CuSO4发生置换反应。
(3)如改用NaOH作电解质,在滤纸上能看到有蓝色沉淀,溶液中应有Cu2+生成,Cu作负极,为B。
负极:2Cu+4OH--4e-====2Cu(OH)2
正极:O2+2H2O+4e-====4OH-。
