问题
计算题
(10分)常温下,在20g盐酸和硫酸混合液中,逐滴加入17.1%的氢氧化钡溶液。当碱液滴加至20g时,硫酸钡沉淀达到量大值;当碱液滴加至60g时,溶液pH等于7。求:
(1)起始混合液中硫酸的质量分数。
(2)起始混合液中HCl的质量分数。
(3)25℃时,当溶液pH=7时,蒸发掉溶液中的水43.02g,冷却至原温度后,过滤烘干得4.98g固体。求此时氯化钡的溶解度。
答案
(1)与硫酸反应的氢氧化钡: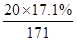 =0.02mol
=0.02mol
故原混合物中硫酸的质量分数为: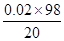 ×100%=9.8%
×100%=9.8%
(2)与盐酸反应的氢氧化钡: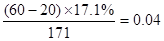 mol
mol
故原混合物中HCl%: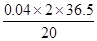 ×100% = 14.6%
×100% = 14.6%
(3)沉淀中硫酸钡的质量:0.02×233 = 4.66g。
生成氯化钡:0.04×208=8.32g,因为4.98>4.66,故其中也有氯化钡固体析出,留下的溶液为氯化钡的饱和溶液,析出氯化钡质量:4.98-4.66=0.32g。
饱和氯化钡溶液中溶有氯化钡的质量为:8.32-0.32=8.00g
饱和溶液的质量:(20+60)-(43.02+4.98)=32.00g
氯化钡的溶解度: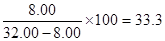 g
g
考查pH、质量分数及溶解度的有关计算。
