(1)现有如下两个反应:
A.NaOH + HCl =" NaCl" + H2O B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因
(2)如图所示装置,烧杯中盛有滴有酚酞的NaCl饱和溶液,C(1)、C(2)为多孔石墨电极。
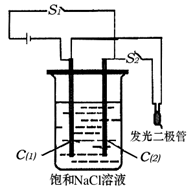
①接通S1后,两极均有气体生成,C(1)附近溶液显 色。装置内发生的总反应化学方程式为 。
②若有11.7g NaCl发生反应,理论上生成Cl2的体积(标准状况)为 。
③反应一段时间后(电极未脱离液面),断开S1,接通S2,观察到二极管发光。此时:C(2)的电极反应式是 。
(1)B A为非氧化还原反应
(2)红 2NaCl+2H2O = 2NaCl+Cl2↑+ H2↑ 2.24L Cl2+2e—=2Cl—
(1)原电池是电子在线路中定向移动,所以原电池反应必须是氧化还原反应
(2)①接通S1后,此装置为电解饱和氯化钠的装置:2NaCl+2H2O = 2NaCl+Cl2↑+ H2↑
负极所对应电极为阴极C(1):2H++2e-=H2↑
+ |
③断开S1,接通S2,则形成了原电池,总反应为:H2+Cl2=2HCl,C(1)极为氢气极,失电子,为负极;C(2)极为氯气极,得电子为正极。
