(18分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
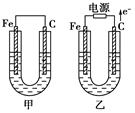
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _
(2)若两池中均为饱和NaCl溶液:
①乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”),写出乙池中该电极反应的离子方程式_______________________________________。
②甲池中碳极上电极反应式是_____________,检验该负极反应产物的方法是_____________________________用离子方程式表示_______________________________
③若乙池转移0.02 mol e-后停止实验,池中溶液体积是200 mL,则溶液混匀后的pH=________。
(1)①碳 铁
②4OH--4e-===2H2O+O2↑
(2)① 氧化反应 2Cl--2e-=Cl2↑-
②2H2O+O2+4e-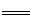 =4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-
=4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-  = Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
= Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
③13
(1)①碳(正极) 铁(阴极)
②阳极为碳棒,失电子,4OH--4e-===2H2O+O2↑
(2)① 氧化反应 2Cl--2e-=Cl2↑-
②2H2O+O2+4e- =4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-
=4OH- 滴加2滴铁氰化钾溶液,看到有蓝色沉淀出现,说明生成了Fe2+ 3Fe2+ +2[Fe(CN)6]3-  = Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
= Fe3[Fe(CN)6]2(蓝色),生成物叫普鲁士蓝
③H+ 浓度为:0.02mol/0.200L=0.1mol/L,pH= 13
