(12分)某化学兴趣小组利用下图所示原电池装置进行实验,请回答下列问题:
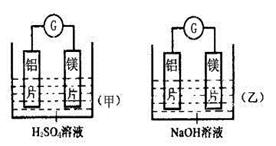
(1)实验中,同学们发现两装置电流计的指针偏转方向不同,因此有人提出以下观点,其中正确的是____________。(双选题,漏选得1分,多选错选得0分)
A.金属活动性铝比镁强
B.金属活动性镁比铝强,两装置中镁均为负极
C.仅根据金属活动性顺序不能准确判断原电池的正负极
D.原电池中的正负极受电解质溶液的酸碱性、强氧化性等因素的影响(2)写出甲图中的电极反应式:
①正极:__________________________________________;
②负极:__________________________________________。
(3)乙图中铝片与NaOH溶液反应的总化学方程式为______________________。某同学测得乙图中实验前铝片的质量是10g,实验后的质量是4.6g,则在实验过程中产生氢气的体积为 L(标况),转移电子的物质的量为 mol。
(1)CD(双选题,漏选得1分,多选错选得0分)
(2)①2H++2e―==H2↑; ②Mg - 2e―==Mg2+
(3)2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 6.72L ,0.6mol
(1)在一般情况下,原电池中较活泼的金属作负极,较不活泼的金属作正极。但是还需要考虑所用的电解质溶液。由于镁和氢氧化钠不反应,铝和氢氧化钠反应,所以此时作负极的是铝,而不是镁,镁作正极。所以正确的答案是CD。
(2)甲装置中镁是负极,失去电子。铝是正极,溶液中的氢离子得到电子,生成氢气。
(3)铝和氢氧化钠反应生成氢气、偏铝酸钠和水,反应式为2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑。根据题意可知,消耗的铝是10g-4.6g=5.4g,物质的量是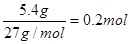 。所以生成氢气是0.3mol,转移电子是0.2mol×3=0.6mol。
。所以生成氢气是0.3mol,转移电子是0.2mol×3=0.6mol。
