(16分)甲烷的氯化反应式为:
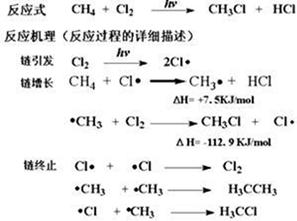
(1)在链增长的第二部反应中形成的化合物的电子式为 ;
(2)在反应机理的三个阶段破坏或形成的化学键类型均为 ;
(3)在短周期主族元素中,氯元素及与其相邻元素的电负性有大到小的顺序是 (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(4)链引发的反应为 ;链终止的反应为 (填“吸热”或“放热”)
(5)卤素单质及化合物在许多物质上都存在着递变规律。下列有关说法正确的是 。
a.相同条件下卤化银的Ksp按AgCl、AgBr、AgI 的顺序依次增大
b.卤化氢溶入水的酸性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d.卤素单质氧化性按F2、Cl2、Br2、I2的顺序依次减弱
(6)卤化氢的键能与键长大小如下表。
| HF | HCl | HBr | HI | |
| 键能/kJ·mol-1 | 568.6 | 431.8 | 365.7 | 298.7 |
| 键长/pm | 92 | 127.6 | 141.0 | 162 |
①卤素单质非金属性越强,与氢化合生成的氢化物越 (填“稳定”或“不稳定”)。
②卤化氢的键长与卤离子的半径的关系是: 。
(1)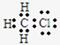 (2分)
(2分)
(2)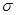 (2分)
(2分)
(3)F>Cl>S(2分) 三 ⅠA(2分)
(4)吸热 放热(2分)
(5)d(2分)
(6)稳定(2分) 卤离子半径越大,形成的氰化物的键长越长(2分)
本题以以大学有机化学中烷烃氯化的自由自反应机理:链引发、链增长、链终止三个阶段为载体,考查中学化学主要知识点:电子式的书写、共价键类型、电负性大小比较、元素周期表、元素性质递变规律、物质的性质与共价键参数的关系、反应热、难溶物质的浓度积等。第(1)小问考查电子式的书写,考生易漏写“Cl”上的另外6个电子。第(2)、第(3)、第(6)小题:体现安徽省2010年考试说明新增考点:
