(9分) (1)下列反应能设计成化学能转化为电能的装置是
A Zn+CuSO4=ZnSO4+Cu B NaOH+HCl=NaCl+H2O
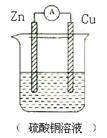
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式:
正极反应 负极反应 .

(3)某烷烃的蒸气质量是相同条件下氢气质量的36倍,该烃的分子式为____________,请写出该烃同分异构体中有4种不同沸点的一氯代物的该烃的结构简式,并命名:
、
(1) A (1分)
(2) Cu2++2e-=Cu (1分)Zn-2e-=Zn2+ (1分)(正极材料只要合理均可)(2分)
(3)C5H12 (1分) (1分) 2-甲基丁烷(或异戊烷)(1分)
(1)因为电子的定向移动才能形成电流,所以只有氧化还原反应才能设计成原电池,即选项A正确。
(2)根据反应式可知,锌是还原剂,失去电子,作负极。铜离子得到电子,在正极得到电子析出。电极反应式分别为负极反应: Zn-2e-=Zn2+、正极反应:Cu2++2e-=Cu。装置图如图所示:
(3)气体的密度之比是相应的相对分子质量之比,所以烷烃的相对分子质量是36×2=72。所以根据烷烃的通式CnH2n+2可知,分子式为C5H12。戊烷有3种同分异构体,其中正戊烷有3种氢原子、异戊烷有4种氢原子,新戊烷有1种。
