(20分)(1)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Fe +H2SO4 = FeSO4 + H2 ↑;根据两反应本质,判断能否设计成原电池A B (填“能”或“不能”)
(2)根据下图填空
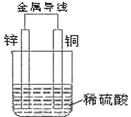
①负极为 ,该电极的方程式为
②正极的现象是 ,发生 反应(填写“氧化”或“还原”)
③电子从 经导线流向 ,溶液中H+向 移动(填具体电极材料)。
④若反应过程中有0.1mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(1)不能 能 (2)① Zn Zn—2e—===Zn2+
② 有气泡产生 还原
③ Zn Cu Cu ④ 1.12L
(1)在原电池中有电子的转移,所以只有氧化还原反应才能设计成原电池,A是中和反应,不能设计成原电池,B是氧化还原反应,可以设计成原电池。
(2)在原电池较活泼的金属作负极,锌比铜活泼,锌是负极,失去发生氧化反应,所失去的电子经导线传递到正极上。铜是正极,溶液中的氢离子向正极移动,在正极上得到电子,发生还原反应生成氢气,电极反应式为2H++2e—===H2↑。若转移0.1mol电子,则生成氢气0.05mol,其体积是0.05mol×22.4L/mol=1.12L。
