问题
计算题
利用铜棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当铜棒上 * * 生3.36L(标准状况)气体时,硫酸恰好全部被消耗。请回答下列问题:
(1)该原电池的正极反应式为:
(2)计算原稀硫酸的物质的量浓度。
(3)若将铜棒换成铁片,仍按题给方式组合起来,能否组成原电池呢? (填“能”或“不能”)若能组成原电池,此原电池的负极反应式是
答案
(1)2H+ + 2e- = H2↑ (2分) (2)0.75mol/L (3分)
(3)能(1分),Zn — 2e- = Zn2+(2分)
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子,反应式为2H+ + 2e- = H2↑。
(2)氢气的体积是3.36L,物质的量是3.36L÷22.4L/mol=0.15mol。根据氢原子守恒可判断,硫酸的物质的量也是0.15mol,其浓度是0.15mol÷0.2L=0.75mol/L 。
(3)铁的活泼性也弱于锌的,所以能构成原电池,锌还是负极,铁是正极。其中负极反应式为Zn — 2e- = Zn2+。

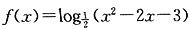 的单调递增区间是().
的单调递增区间是().