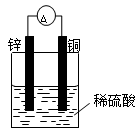
(9分)(1)按下图装置进行实验,可观察到的现象有: 。其中Zn极发生 反应(填“氧化”或“还原”),写出电极反应式 。
(2)有同学把Zn粒放入盛有稀盐酸的试管中,加入几滴CuCl2 溶液,气泡放出的速率加快。其原因是 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为________,当正极消耗5.6 L(标准状况)气体时,外电路转移的电子数为________。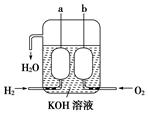
(9分)(1)灵敏电流表的指针发生了偏转,锌片溶解,铜片上有气泡产生(2分)。
氧化(1分) Zn — 2e- ="=" Zn2+ (2分)
(2)锌-铜稀盐酸形成原电池,加快锌的氧化 ( 2分)
(3)H2 6.02×1023 (各1分,共2分)
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子。
(2)锌能置换出铜,从而构成铜锌原电池,锌作负极,加快反应速率。
(3)氢气失去电子,所以氢气在负极通入,氧气在正极通入。因为1mol氧气得到4mol电子,所以转移的电子是5.6L÷22.4L/mol×4=1.0mol。
