问题
填空题
(8分)生活中我们常利用原电池装置对金属进行防护。请你在下图的基础上设计一个原电池装置,阻止铁进一步与硫酸反应。
(1)在图中画出完整的装置图,标出另一电极材料和电子流向。
(2)铁电极是该原电池的_____极,发生 反应,电极反应式为 ,
溶液中的SO42-向_____极移动。
(3)该反应是放热反应,则生成物的总能量_____反应物的总能量(填“>”或“<”)。
答案
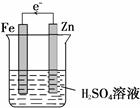
(1)如右图(Zn电极、电子流向各1分,共2分)
(2)正极,还原,2H+ +2e- = H2↑,负极(各1分,共4分) (3)< (1分)
(1)原电池中较活泼的金属作负极,失去电子,发生氧化反应。较不活泼的金属作正极,正极得到电子,发生还原反应。所以要阻止铁和稀硫酸反应,则铁应该是正极,负极是比铁还活泼的金属,所以装置图为(见答案)。
(2)铁是正极,溶液中的氢离子在正极得到电子,发生还原反应,即阳离子向正极移动,则阴离子向负极移动,正极反应式为2H+ +2e- = H2↑。
(3)该反应是放热反应,则生成物的总能量小于反应物的总能量。
