石英的主要成分为二氧化硅,其化学式为SiO2.它是玻璃工业和陶瓷工业的原料,冶金工业的助熔剂.
(1)二氧化硅属于______(填“酸”、“碱”、“盐”、“氧化物”或“有机物”中一种).
(2)装有氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,Na2SiO3使瓶口与瓶塞粘合在一起,该反应的化学方程式为______.
(3)硅是太阳能电池和电脑芯片不可缺少的材料.生产高纯硅的流程示意图如下:
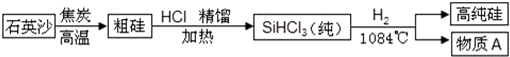
①制备粗硅的反应为:SiO2+2C
Si+2CO↑,反应的基本类型是______反应(填“分解”“化合”“置换”“复分解”之一). 高温 .
②整个制备过程必须达到无水无氧,若在H2还原SiHCl3过程中混入O2,可能引起的后果是______.
(1)二氧化硅是由硅、氧两种元素组成的且有一种是氧元素的化合物,属于氧化物.
(2)常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,反应的化学方程式为:2NaOH+SiO2=Na2SiO3+H2O.
(3)①制备粗硅的反应:SiO2+2C
Si+2CO↑,该反应符合一种单质和一种化合物生成另一种单质和另一种化合物,属于置换反应. 高温 .
②在H2还原SiHCl3过程中混入O2,还原出的Si会被再次氧化,得不到高纯硅;氢气具有可燃性,与氧气混合达到爆炸极限时在加热或点燃条件下会发生爆炸,故整个制备过程必须达到无水无氧.
故答案为:(1)氧化物;(2)2NaOH+SiO2=Na2SiO3+H2O;(3)①置换;②硅被氧化得不到高纯硅,且可能发生爆炸.
