问题
选择题
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时反应为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O下列结论正确的是( )
A.Pb为正极被氧化
B.SO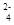 只向PbO2极移动
只向PbO2极移动
C.电解质溶液密度不断减小
D.溶液的pH值不断减小
答案
答案:C
题目分析:A.由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,Pb为负极,发生失电子的氧化反应,被还原,故A错误;
B、原电池中阳离子向正极移动,阴离子硫酸根向负极Pb极移动,故B错误;
C、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,电解质溶液密度不断减小,故C正确;
D、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,硫酸被消耗,pH不断增大,故D错误.
故选C。
点评:本题考查原电池的工作原理,题目难度中等,本题注意电极反应式的书写,为解答该题的关键。
