Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________________,原因是____________________.试管里的水面会上升,最终上升高度约为_______,原因是_________________________________________________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
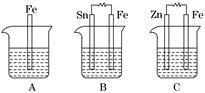
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
Ⅰ.铁丝表面生成一层红棕色的铁锈 铁发生吸氧腐蚀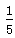 空气中氧气的体积分数约为1/5,经过足够长的时间后,氧气与铁反应完
空气中氧气的体积分数约为1/5,经过足够长的时间后,氧气与铁反应完
Ⅱ.(1)Fe+2H+===Fe2++H2↑
(2)2H++2e-===H2↑ 增大
(3)Zn Zn+2H+===Zn2++H2↑ B>A>C
题目分析:该装置中铁丝发生吸氧腐蚀生成铁锈(Fe2O3·nH2O),经过足够长的时间后,试管内空气中的氧气完全被吸收,导致压强减小,液面上升,上升高度与空气中所含氧气的体积分数相同,约占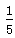 .
.
(Ⅱ)A中Fe失电子,氢离子得到电子被还原为氢气;B中形成原电池,Sn为正极,为电子流入的一极,氢离子得电子被还原产生氢气,由于消耗了溶液中的氢离子,所以pH增大;C中锌作负极被氧化,Zn-2e-===Zn2+,正极:2H++2e-===H2↑,总反应为Zn+2H+===Zn2++H2↑,C中Fe被保护,B中能加快腐蚀.
点评:本题考查铁的腐蚀相关的电化学知识,难度不大,侧重考查学生实验观察能力及分析问题能力,解题的关键是要读懂图,了解问题的实质。
