[化学—选修2:化学与技术](15分)
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是____________________,电解质的主要成分是__________,正极发生的主要反应是________________________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
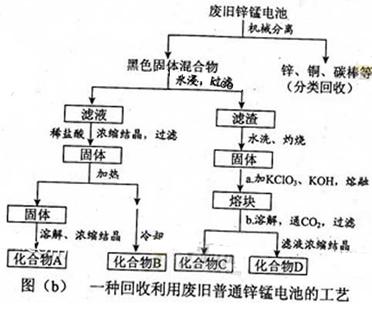
①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是____。(填化学式)
(1)①Zn NH4Cl MnO2+NH4++e-=" MnOOH+" NH3
②碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)①ZnCl2 NH4Cl ②3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32- ③H2
(1)根据化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,锌是负极材料,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应, MnO2+NH4++e-=" MnOOH+" NH3。与普通锌锰电池相比,碱性锌锰电池的优点及其理由是碱性电池不易发生电解质的泄露,因为消耗的负极改装在电池的内部,碱性电池的使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高。
(2)废电池经机械分离后,加水溶解后再加稀盐酸,浓缩结晶得到氯化铵和氯化锌。氯化铵不稳定,受热易分解,所以B为氯化铵,A为氯化锌。绿色的K2MnO4溶液发生反应后生成紫色的高锰酸钾溶液和黑褐色的二氧化锰,该反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-。采用惰性电极电解K2MnO4溶液,阴极氢离子得电子生成氢气。
【考点定位】化学与技术、原电池原理、电极方程式的书写
