问题
选择题
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下左图所示。下列说法中,正确的是
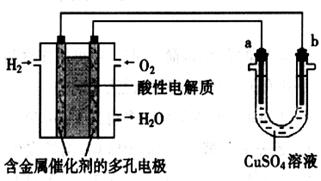
A.若a极是铜,b极为铁时,当电池消耗1.6g O2,b极上析出6.4g铜
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。
D.若a、b两极均是石墨时,b极反应为4OH- - 4e-=O2↑+ 2H2O
答案
答案:D
题目分析:有题可以知道,通入氢气的一极为负极,b为阴极,通入氧气的一极为正极,所以a极为阳极。A正确,若a极是铜,b极为铁,则a极中Cu溶解,在b极析出,根据串联电路电流处处相等,可以知道当消耗1.6g O2,即转移了0.2mol电子,即析出0.1mol铜,即析出6.4g铜;B错误,应该为
O2+2H+ + 2e-=2OH-,C错误,若a极是粗铜,b极是纯铜时,a极减少的质量不一定与b极上析出铜的质量相等,因为粗铜含有其他的杂质,D错误,应该是a极发生4OH- - 4e-=O2↑+ 2H2O。
点评:本题考查了原电池、电解池的综合知识,该命题方式是高考命题的热点,本题有一定的综合性,有一定的难度。
