现有如下两个反应:A.2NaOH+H2SO4==Na2SO4+2H2O B.CH4+2O2==CO2+2H2O
(1)根据反应的本质,两个反应都为 反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)
A B
(2)如果不能,说明其理由
(3)如果能,最好应选择 电解质溶液(NaOH或H2SO4)。
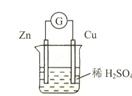
(4)上图是一个原电池装置,则负极电极反应式:
正极电极反应式:
(1)、放热, A不能 , B能 (2)、A的反应为非氧化还原反应,无电子转移
(3)、NaOH (4)负 Zn-2e—= Zn2+ 正 2H++2e—= H2↑
题目分析:(1)A.2NaOH+H2SO4==Na2SO4+2H2O为中和反应, B.CH4+2O2==CO2+2H2O为燃烧反应,所以根据反应的本质,两个反应都为放热反应,因为A的反应为非氧化还原反应,无电子转移,所以A不能设计为原电池,B反应为氧化还原反应,有电子的转移,所以B可以设计为电池,B的产物为二氧化碳,所以要采用氢氧化钠溶液,才能将产生的二氧化碳吸收;(4)该装置为锌铜原电池,锌极为负极,其发生的反应为 Zn-2e—= Zn2+ ;铜极为正极,其发生的反应为:2H++2e—= H2↑。
点评:本题考查了氧化还原反应,原电池的工作原理,这些考点都是高考考查的重点和难度,本题难度中等。
