关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3—对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将NO3—还原为N2,其化学方程式为:10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O。
请回答下列问题:
①上述反应中_________元素的化合价升高,则该元素的原子____________(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳制取漂白粉,化学方程式是_________________________________。
②漂白粉的有效成分是(填化学式)____________________________。
③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,离子方程式为___________________。
(1)① Al 失去
②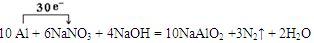
(2) ① 2 Ca(OH)2 + 2 Cl2 = CaCl2 + Ca(ClO)2 + 2 H2O ②Ca(ClO)2
③Ca2+ +2ClO- + CO2 + H2O = CaCO 3↓ + 2HClO
题目分析:(1)①在反应10 Al + 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑ + 2 H2O中Al元素的化合价由反应前单质Al的0价变为反应后的NaAlO2中的+3价,化合价升高,该元素的原子失去电子,被氧化,作还原剂。②用单线桥法表示反应中电子转移的方向和数目为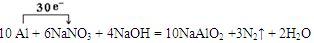
(2)①工业上将氯气通入石灰乳制取漂白粉,化学方程式是2 Ca(OH)2 + 2 Cl2 = CaCl2 + Ca(ClO)2 + 2 H2O. ②漂白粉的有效成分是Ca(ClO)2。③漂白粉溶于水后,受空气中的CO2作用,即产生漂白、杀菌作用,Ca(ClO)2+ CO2 + H2O = CaCO 3↓ + 2HClO离子方程式为Ca2+ +2ClO- + CO2 + H2O = CaCO 3↓ + 2HclO.
