近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 .用这种方法处理SO2废气的优点是 .
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
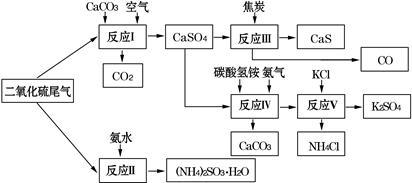
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 .
②下列有关说法正确的是 .
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑
CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 .
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式 .
(共15分)
(1) 负(2分) SO2+2H2O-2e-=SO42-+4H+ (2分)
利用上述电池,可回收大量有效能,副产品为H2SO4,减少环境污染,实现(能质)共生。(2分)
(2)①防止亚硫酸铵被氧化(1分) ②ABCD(4分)
③K2SO4在有机溶剂乙二醇中溶解度小,能充分析出(2分)
④4(NH4)2SO3+2NO2=4(NH4)2SO4+N2(2分)
题目分析:
(1)原电池负极发生氧化反应,正极发生还原反应,依据元素化合价变化可知,二氧化硫中硫元素化合价升高,失电子发生氧化反应。因此应将SO2通入电池的负极,电极反应为:SO2+2H2O-2e-=SO42-+4H+;此方法的优点是污染小,生成产物可以循环利用,可以回收有效能;
(2)①向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,防止亚硫酸根被氧化,以更好的得到亚硫酸铵晶体;
②A、依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙,正确;
B、依据流程图中的反应物和生成物,结合元素化合价变化分析,正确;
C、防止碳酸氢铵在温度过高时分解得不到需要的目标产物,正确;
D、氯化铵是一种氮肥,正确;
③硫酸钾在40%的乙二醇溶液中溶解度比在水中的小,有利于析出;
④二氧化氮具有强氧化性能氧化亚硫酸铵,生成硫酸铵,本身被还原为氮气,原子守恒配平书写出的化学方程式为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
