问题
填空题
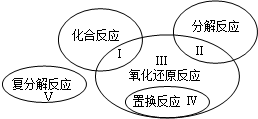
已知氧化还原反应与四种基本反应类型的关系可用如图表示,下列是有水参加或生成的几种反应:
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO 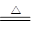 Cu +H2O
Cu +H2O
④3S+6NaOH 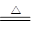 2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
请回答下列问题:
(1)反应①中水 (填字母)。
A.是氧化剂
B.是还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂(2)反应③被氧化的元素是 (填元素符号)。
(3)上述反应中,属于区域Ⅲ的是 (填序号)。
(4)写出一种符合区域Ⅴ且既有沉淀生成又有水生成的离子方程式: 。
答案
(1)D (2)H (3)④
(4)H2CO3+Ca2++2OH-=CaCO3+2H2O(只要符合题意:既有沉淀生成又有水生成的复分解反应的离子方程式)
题目分析:(1)CaO+H2O =Ca(OH)2该反应中,水所含的H、O元素化合价均为改变,故水既不是氧化剂又不是还原剂。选择D选项。(2)H2+CuO 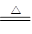 Cu +H2O根据反应可知,H元素化合价升高,Cu元素化合价降低,故被氧化的元素为H元素。(3)Ⅲ区域为氧化还原反应,且不属于置换、化合、分解反应,故④符合题意。(4)Ⅴ区域为复分解反应,且有沉淀,水生成。H2CO3+Ca2++2OH-=CaCO3+2H2O
Cu +H2O根据反应可知,H元素化合价升高,Cu元素化合价降低,故被氧化的元素为H元素。(3)Ⅲ区域为氧化还原反应,且不属于置换、化合、分解反应,故④符合题意。(4)Ⅴ区域为复分解反应,且有沉淀,水生成。H2CO3+Ca2++2OH-=CaCO3+2H2O
