问题
填空题
将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。
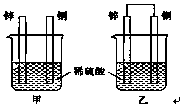
(1)以下叙述中,正确的是 (填标号)。
A.装置甲、乙中铜片表面均无气泡产生
B.装置甲、乙中稀硫酸的浓度均减小
C.装置乙中锌片是正极,铜片是负极
D.装置乙中产生气泡的速率比装置甲快(2)装置乙中,总反应的离子方程式为 ;若导线上通过0.2 mol电子,消耗锌的质量为 g。
答案
(6分,每空2分)(1)B D (2)Zn + 2H+ =Zn2+ + H2↑ ; 6.5
题目分析:(1)根据装置图可判断,乙装置是原电池,发生电化学腐蚀。其中锌是负极,铜是正极。甲装置发生化学腐蚀,锌直接与稀硫酸反应,而铜不能反应,据此可以解答。
乙是原电池,其中铜是正极,溶液中的氢离子在正极放电放出氢气,故A错误;两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故B正确;乙是原电池,其中铜是正极,锌是负极,C不正确;通过原电池发生的反应速率要快于化学反应,选项D正确,因此答案选BD。
(2)装置乙中,总反应的离子方程式为Zn + 2H+ =Zn2+ + H2↑。若导线上通过0.2 mol电子,则根据电极反应式Zn-2e-=Zn2+可知,消耗锌的物质的量是0.1mol,质量为0.1mol×65g/mol=6.5g。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确原电池的工作原理,特别是电极名称、电极反应式的书写,并能结合题意和装置图灵活运用即可。
