脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
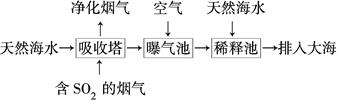
①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。
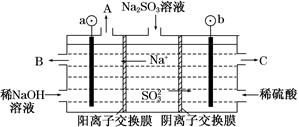
①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
(1)2SO2+O2+2CaCO3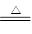 2CaSO4+2CO2
2CaSO4+2CO2
(2)①将H2SO3、HSO3—等氧化为SO42— ②bd
(3)①负 硫酸
②SO32—-2e-+H2O=SO42—+2H+
③H2O H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
(1)煤燃烧时,石灰石在高温下分解产生CaO和CO2,CaO为碱性氧化物,可以与SO2、O2反应生成CaSO4,该反应的化学方程式是2SO2+O2+2CaCO3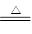 2CaSO4+2CO2。(2)SO2为酸性氧化物,海水呈弱碱性,曝气池中通入空气的目的是将SO32—、HSO3—等氧化。通入空气后溶液中SO42—的浓度增大,HCO3—的浓度减小。(3)电解Na2SO3溶液,根据图示,a极应为阴极,要连接电源的负极,C口流出的物质是硫酸。阴极的电极反应式为2H++2e-=H2↑,阳极的电极反应式为SO32—-2e-+H2O=SO42—+2H+。电解过程中H+在阴极放电生成H2,阴极区存在平衡H2O
2CaSO4+2CO2。(2)SO2为酸性氧化物,海水呈弱碱性,曝气池中通入空气的目的是将SO32—、HSO3—等氧化。通入空气后溶液中SO42—的浓度增大,HCO3—的浓度减小。(3)电解Na2SO3溶液,根据图示,a极应为阴极,要连接电源的负极,C口流出的物质是硫酸。阴极的电极反应式为2H++2e-=H2↑,阳极的电极反应式为SO32—-2e-+H2O=SO42—+2H+。电解过程中H+在阴极放电生成H2,阴极区存在平衡H2O H++OH-,c(H+)减小,水的电离平衡正向移动,碱性增强。
H++OH-,c(H+)减小,水的电离平衡正向移动,碱性增强。

