问题
选择题
将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为:Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如右图的原电池,则下列说法一定错误的是
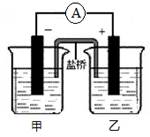
A.Cd作负极,Co作正极
B.原电池工作时,电子从负极沿导线流向正极
C.根据阴阳相吸原理,盐桥中的阳离子向负极(甲池)移动
D.甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液
答案
答案:C
题目分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此根据反应式Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)(aq表示溶液)可知,Cd是还原剂,作负极。Co2+得到电子,是氧化剂,在正极放电。根据装置可知,甲是负极,乙是正极。A、Cd作负极,Co作正极,A正确;B、原电池工作时,电子从负极沿导线流向正极,B正确;C、根据阴阳相吸原理,盐桥中的阳离子向正极(乙池)移动,C不正确;D、甲是负极,乙是正极,所以甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液,D正确,答案选C。
