化学能与电能之间的相互转化与人类的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
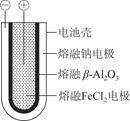
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池,如图9-8工作原理示意图,反应原理为2Na+FeCl2 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为________。
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液,工作原理示意图如图所示,一段时间停止通电取出电极。若在电解后的溶液中加入0.98 g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题:
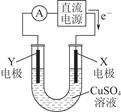
①Y电极材料是________,发生________(填“氧化”或“还原”)反应。
②电解过程中X电极上发生的电极反应式是_______________________________________________________________________。
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是__________。
(1)Fe2++2e-=Fe 钠 β—Al2O3
(2)①石墨 氧化
②Cu2++2e-=Cu 2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-
③0.448 L或448 mL
(1)该电池的电解质为熔融的βAl2O3,熔融的钠电极作负极,钠发生失电子的氧化反应;熔融的FeCl2电极作正极,Fe2+发生得电子还原反应,充电时,电池负极接电源负极,电池正极接电源正极。(2)由加入Cu(OH)2可使电解质溶液复原,可知阳极为石墨,阴极为铜片。相当于惰性电极电解硫酸铜溶液,硫酸铜消耗完后又电解的水,故阴极首先发生的反应为Cu2++2e-=Cu,Cu2+消耗尽后又发生反应2H++2e-=H2↑。根据电子守恒和铜元素的守恒,溶液中生成的n(H+)=2n(Cu2+)=2×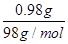 =0.02 mol,与足量NaHCO3反应可产生0.02 mol CO2。
=0.02 mol,与足量NaHCO3反应可产生0.02 mol CO2。
