问题
填空题
如下图所示,烧杯中都盛有稀硫酸。
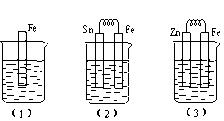
①写出(3)中的电极反应:Fe: 、 Zn: 。
②比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (填序号)。
答案
①2H+ + 2e- =H2↑ Zn-2e-=Zn2+(各2分)
②2、1、3(1分)
题目分析:①装置(3)为原电池,Zn较活泼,电池反应为:Zn +H2SO4=ZnSO4+H2↑,锌失电子发生氧化反应,作原电池的负极,电极反应式为Zn-2e-=Zn2+;氢离子在铁电极上得电子发生还原反应,电极反应式为2H+ + 2e- =H2↑;②装置(2)中铁作原电池的负极,腐蚀速率加快,装置(3)中铁作原电池的正极,被保护,(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是(2)、(1)、(3)。
